GiantMuscle
Well-Known Member
Le Protocole le Plus Efficace d'Hormone de Croissance pour la Perte de Graisse
Q : Quel protocole d'hormone de croissance trouvez-vous le plus efficace pour la perte de graisse ?
Quels éléments seront inclus dans cet article (pour ceux qui ne se soucient pas de la manière dont j'en suis arrivé à ma conception de pile recommandée et qui veulent simplement la réponse, n'hésitez pas à passer à la section "application pratique") :
- Historique de l'hormone de croissance et de la perte de graisse
- Qu'est-ce que la lipolyse ?
- L'hormone du stress / Relation entre l'hormone de croissance et le jeûne
- Mécanismes d'action - Lipolyse induite par l'hormone de croissance
- Taux maximal de lipolyse
- Pharmacocinétique / Pharmacodynamique
- Synergies de composés
- Application pratique et exemple de conception de pile
HISTORIQUE DE L'HORMONE DE CROISSANCE ET DE LA PERTE DE GRAISSE
L'hormone de croissance (GH) est un agent très puissant de mobilisation des graisses, connu des chercheurs dès les années 1920, lorsque des essais animaux primitifs ont démontré que les animaux traités à la pituitaire étaient systématiquement plus maigres que les animaux témoins non traités [1-2]. Cependant, ce n'est qu'en 1945, lorsque la GH a été extraite pour la première fois de la pituitaire [3], que les scientifiques ont vraiment commencé à isoler les effets de mobilisation des graisses de la pituitaire à ce polypeptide spécifique.
QU'EST-CE QUE LA LIPOLYSE ?
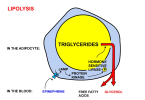
La lipolyse est le processus physiologique qui fournit au corps un substrat énergétique sous forme d'acides gras par le catabolisme des triglycérides stockés. Les triglycérides stockés dans les gouttelettes lipidiques des adipocytes sont hydrolysés en acides gras et en glycérol, puis libérés dans la circulation pour être oxydés et produire de l'ATP [4-5]. Il sera quelque peu important de comprendre les différences entre la mobilisation et l'oxydation ; cependant, une revue complète de la lipolyse dépasse le cadre de cet article.
L'HORMONE DU STRESS ET LA RELATION AVEC LE JEÛNE
La GH est une hormone du stress, de par sa nature même, sa sécrétion endogène étant amplifiée lors d'événements stressants tels que le jeûne et l'exercice [6]. Pour le reste de cet article, cependant, nous allons nous concentrer davantage sur le rôle de la GH pendant le jeûne et sur la manière dont elle est applicable à ceux qui cherchent à maximiser le potentiel lipolytique de leurs conceptions de pile de GH exogène.
La période de jeûne (post-absorptif) commence environ six heures après l'ingestion d'aliments et les objectifs principaux du corps pendant cette étape sont de fournir, de convertir et de conserver les substrats de carburant pour le corps. Pendant cette période, il y a une élévation significative du taux de sécrétion endogène de GH qui peut durer de 48 à 72 heures [7-8]. L'élévation de la GH sécrétée est directement liée à l'amplitude de l'impulsion, tandis que la fréquence des impulsions et les niveaux entre les impulsions restent essentiellement inchangés [9]. Pendant le jeûne, la GH est la seule hormone anabolique à augmenter tandis que les niveaux d'hormones cataboliques (comme le glucagon, le cortisol, l'épinéphrine, etc.) augmentent tous.
MÉCANISMES D'ACTION - LIPOLYSE INDUITE PAR LA GH
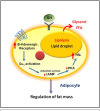
Les taux élevés de sécrétion de GH entraînent de nombreux changements métaboliques, importants à comprendre. La première priorité du corps pendant le jeûne est de maintenir l'homéostasie du glucose, afin de fournir suffisamment de glucose au cerveau et à d'autres tissus (comme les globules rouges) qui dépendent de ce carburant [10]. Pour atteindre cet objectif, le corps oriente sa préférence d'apport en carburant vers les substrats gras, de manière à pouvoir simultanément conserver le glucose précieux et les réserves d'acides aminés. Parallèlement à ce changement de préférence de carburant vers les substrats gras par les tissus musculaires et le foie, la mobilisation du glycogène se produira car aucune prise alimentaire de glucose n'est détectée. De grandes quantités de glucose sont également libérées par le foie dans le sang pour aider à maintenir les niveaux de glucose dans le sang en l'absence de glucose alimentaire. Ceci est réalisé en grande partie grâce à la baisse simultanée des niveaux d'insuline sérique, qui empêche le glucose libéré d'entrer dans les tissus musculaires et adipeux.
De plus, la GH élevée entraîne un état de résistance à l'insuline, essentiel à la préservation des réserves de glucose précieuses. Les effets antagonistes de l'insuline que la GH apporte réduisent l'oxydation du glucose et, inversement, le besoin de précurseurs gluconéogéniques issus des réserves de protéines musculaires [11], tuant ainsi deux oiseaux d'un coup. Il existe quelques réflexions sur la question de savoir si la GH elle-même ou l'élévation des acides gras libres sont principalement responsables de cette résistance accrue à l'insuline, mais cela commence à entrer dans le domaine du transport cellulaire et des voies de signalisation, nous réservons donc cette discussion pour un article ultérieur. En résumé, pendant le jeûne, l'augmentation de la sécrétion de GH contribue à mobiliser les acides gras libres des adipocytes, à réduire GLUT-1 pour inhiber la capture du glucose dans les tissus périphériques, à prévenir l'oxydation du glucose par une résistance accrue à l'insuline, et à conserver les réserves d'acides aminés à la fois par des moyens directs et indirects.
Il est bien connu que la GH influence la lipolyse, mais les mécanismes exacts par lesquels elle
le fait restent en partie mystérieux. On a supposé que cela pourrait être multifactoriel, la GH montrant la capacité de réduire la lipase lipoprotéique (LPL) du tissu adipeux, de stimuler la lipase sensible aux hormones (HSL) et d'antagoniser les effets antilipolytiques de l'insuline. L'augmentation de l'expression de HSL dans les adipocytes augmente le potentiel lipolytique car HSL est étroitement impliquée dans le processus d'hydrolyse des triglycérides. Une fois activée, HSL est transloquée à la périphérie de la gouttelette de graisse intracellulaire où elle hydrolyse les triglycérides en AG et en glycérol. Elle est également reconnue par beaucoup comme l'enzyme déterminante de la lipolyse [12]. À noter cependant que toutes les études n'ont pas montré universellement que la GH augmentait les niveaux d'ARNm de HSL dans les adipocytes [13-14].
Comme mentionné, il a également été démontré que la GH a un impact direct sur la suppression de l'activité de LPL dans les tissus adipeux humains, bien que cela n'ait pas été démontré dans les tissus musculaires squelettiques [15-17]. Pourquoi cela pourrait être pertinent pour quelqu'un intéressé par la perte de graisse est que la LPL est directement impliquée dans l'élimination des acides gras du sang et les stocke ensuite dans les adipocytes et/ou les fournit aux tissus musculaires squelettiques pour le carburant. Ainsi, si la LPL peut être supprimée dans les tissus adipeux, on pourrait spéculer que moins de substrats gras seront activement stockés (ré-estérifiés) et plus seront disponibles pour alimenter les processus métaboliques.
Des études menées sur des adipocytes humains en culture ont montré que la GH n'a en fait aucun effet direct sur la lipolyse [18], mais elle augmente considérablement la sensibilité aux catécholamines dans ces cellules, suggérant que la GH active la lipolyse à un stade après l'implication des récepteurs bêta-adrénergiques et/ou des protéines G. En fait, il est raisonnable de spéculer que la GH pourrait augmenter la densité des récepteurs bêta-adrénergiques, ce qui pourrait potentiellement devenir très intéressant. Il a déjà été démontré précédemment qu'il existe des récepteurs bêta-adrénergiques "en réserve" sur les adipocytes humains et une augmentation aiguë du nombre de récepteurs couplés augmenterait la sensibilité et finalement le potentiel lipolytique [19]. De plus, chez les modèles animaux, il a été démontré que la GH augmentait spécifiquement l'expression des récepteurs β3-adrénergiques dans les adipocytes, suivie de l'activation de HSL [20]. Ainsi, en plus des effets directement médiés par la GH, il est logique de penser que l'utilisation d'un agoniste bêta-adrénergique pourrait très probablement créer un effet additif sur le processus lipolytique.
TAUX MAXIMAL DE LIPOLYSE
Donc, alors que nous travaillons à créer une pile qui maximise le potentiel lipolytique, y a-t-il une limite réelle (ou théorique) à la vitesse à laquelle elle se produira ? En fait, nous avons une réponse ; du moins en ce qui concerne uniquement le taux maximal auquel la GH administrée par voie intraveineuse peut provoquer la lipolyse [21]. On a constaté que cela correspondait à une dose d'environ 3 µg/kg (correspondant à une concentration moyenne de GH de pointe de 32,4 µg/litre). La dose n'était pas dépendante de l'âge ni du sexe et correspond à peu près à l'équivalent de 1,2 à 1,5 UI pour un homme maigre de 100 kg. Une dose supérieure à cela n'entraîne pas en réalité un impact plus important sur la lipolyse. Il se trouve simplement que c'est aussi essentiellement la limite supérieure des rafales sécrétoires endogènes naturelles [22]. On suppose que cela pourrait être une limitation, ou un goulot d'étranglement, causé en partie par les taux de clairance extra-rénale associés aux niveaux circulants de GHBP [23].
Il y a des preuves que c'est un goulot d'étranglement spécifique à la GH, et que les traitements combinés avec des variants de catécholamines produisent un effet additif sur la lipolyse, supérieur à chaque traitement pris individuellement [24-27], ce qui conforte davantage l'idée que la GH est un médiateur de la lipolyse. Certains ont qualifié cela d'effet permissif sur la lipolyse induite par les catécholamines [28]. De manière anecdotique, il semble que la GH associée à la présence de composés stimulant les catécholamines [29] ait un effet additif les uns sur les autres. Et nous approfondirons un peu cela plus tard dans l'article.
PHARMACOCINÉTIQUE, PHARMACODYNAMIQUEQ : Quel protocole d'hormone de croissance trouvez-vous le plus efficace pour la perte de graisse ?
Quels éléments seront inclus dans cet article (pour ceux qui ne se soucient pas de la manière dont j'en suis arrivé à ma conception de pile recommandée et qui veulent simplement la réponse, n'hésitez pas à passer à la section "application pratique") :
- Historique de l'hormone de croissance et de la perte de graisse
- Qu'est-ce que la lipolyse ?
- L'hormone du stress / Relation entre l'hormone de croissance et le jeûne
- Mécanismes d'action - Lipolyse induite par l'hormone de croissance
- Taux maximal de lipolyse
- Pharmacocinétique / Pharmacodynamique
- Synergies de composés
- Application pratique et exemple de conception de pile
HISTORIQUE DE L'HORMONE DE CROISSANCE ET DE LA PERTE DE GRAISSE
L'hormone de croissance (GH) est un agent très puissant de mobilisation des graisses, connu des chercheurs dès les années 1920, lorsque des essais animaux primitifs ont démontré que les animaux traités à la pituitaire étaient systématiquement plus maigres que les animaux témoins non traités [1-2]. Cependant, ce n'est qu'en 1945, lorsque la GH a été extraite pour la première fois de la pituitaire [3], que les scientifiques ont vraiment commencé à isoler les effets de mobilisation des graisses de la pituitaire à ce polypeptide spécifique.
QU'EST-CE QUE LA LIPOLYSE ?
La lipolyse est le processus physiologique qui fournit au corps un substrat énergétique sous forme d'acides gras par le catabolisme des triglycérides stockés. Les triglycérides stockés dans les gouttelettes lipidiques des adipocytes sont hydrolysés en acides gras et en glycérol, puis libérés dans la circulation pour être oxydés et produire de l'ATP [4-5]. Il sera quelque peu important de comprendre les différences entre la mobilisation et l'oxydation ; cependant, une revue complète de la lipolyse dépasse le cadre de cet article.

L'HORMONE DU STRESS ET LA RELATION AVEC LE JEÛNE
La GH est une hormone du stress, de par sa nature même, sa sécrétion endogène étant amplifiée lors d'événements stressants tels que le jeûne et l'exercice [6]. Pour le reste de cet article, cependant, nous allons nous concentrer davantage sur le rôle de la GH pendant le jeûne et sur la manière dont elle est applicable à ceux qui cherchent à maximiser le potentiel lipolytique de leurs conceptions de pile de GH exogène.
La période de jeûne (post-absorptif) commence environ six heures après l'ingestion d'aliments et les objectifs principaux du corps pendant cette étape sont de fournir, de convertir et de conserver les substrats de carburant pour le corps. Pendant cette période, il y a une élévation significative du taux de sécrétion endogène de GH qui peut durer de 48 à 72 heures [7-8]. L'élévation de la GH sécrétée est directement liée à l'amplitude de l'impulsion, tandis que la fréquence des impulsions et les niveaux entre les impulsions restent essentiellement inchangés [9]. Pendant le jeûne, la GH est la seule hormone anabolique à augmenter tandis que les niveaux d'hormones cataboliques (comme le glucagon, le cortisol, l'épinéphrine, etc.) augmentent tous.
MÉCANISMES D'ACTION - LIPOLYSE INDUITE PAR LA GH
Les taux élevés de sécrétion de GH entraînent de nombreux changements métaboliques, importants à comprendre. La première priorité du corps pendant le jeûne est de maintenir l'homéostasie du glucose, afin de fournir suffisamment de glucose au cerveau et à d'autres tissus (comme les globules rouges) qui dépendent de ce carburant [10]. Pour atteindre cet objectif, le corps oriente sa préférence d'apport en carburant vers les substrats gras, de manière à pouvoir simultanément conserver le glucose précieux et les réserves d'acides aminés. Parallèlement à ce changement de préférence de carburant vers les substrats gras par les tissus musculaires et le foie, la mobilisation du glycogène se produira car aucune prise alimentaire de glucose n'est détectée. De grandes quantités de glucose sont également libérées par le foie dans le sang pour aider à maintenir les niveaux de glucose dans le sang en l'absence de glucose alimentaire. Ceci est réalisé en grande partie grâce à la baisse simultanée des niveaux d'insuline sérique, qui empêche le glucose libéré d'entrer dans les tissus musculaires et adipeux.
De plus, la GH élevée entraîne un état de résistance à l'insuline, essentiel à la préservation des réserves de glucose précieuses. Les effets antagonistes de l'insuline que la GH apporte réduisent l'oxydation du glucose et, inversement, le besoin de précurseurs gluconéogéniques issus des réserves de protéines musculaires [11], tuant ainsi deux oiseaux d'un coup. Il existe quelques réflexions sur la question de savoir si la GH elle-même ou l'élévation des acides gras libres sont principalement responsables de cette résistance accrue à l'insuline, mais cela commence à entrer dans le domaine du transport cellulaire et des voies de signalisation, nous réservons donc cette discussion pour un article ultérieur. En résumé, pendant le jeûne, l'augmentation de la sécrétion de GH contribue à mobiliser les acides gras libres des adipocytes, à réduire GLUT-1 pour inhiber la capture du glucose dans les tissus périphériques, à prévenir l'oxydation du glucose par une résistance accrue à l'insuline, et à conserver les réserves d'acides aminés à la fois par des moyens directs et indirects.
Il est bien connu que la GH influence la lipolyse, mais les mécanismes exacts par lesquels elle
le fait restent en partie mystérieux. On a supposé que cela pourrait être multifactoriel, la GH montrant la capacité de réduire la lipase lipoprotéique (LPL) du tissu adipeux, de stimuler la lipase sensible aux hormones (HSL) et d'antagoniser les effets antilipolytiques de l'insuline. L'augmentation de l'expression de HSL dans les adipocytes augmente le potentiel lipolytique car HSL est étroitement impliquée dans le processus d'hydrolyse des triglycérides. Une fois activée, HSL est transloquée à la périphérie de la gouttelette de graisse intracellulaire où elle hydrolyse les triglycérides en AG et en glycérol. Elle est également reconnue par beaucoup comme l'enzyme déterminante de la lipolyse [12]. À noter cependant que toutes les études n'ont pas montré universellement que la GH augmentait les niveaux d'ARNm de HSL dans les adipocytes [13-14].
Comme mentionné, il a également été démontré que la GH a un impact direct sur la suppression de l'activité de LPL dans les tissus adipeux humains, bien que cela n'ait pas été démontré dans les tissus musculaires squelettiques [15-17]. Pourquoi cela pourrait être pertinent pour quelqu'un intéressé par la perte de graisse est que la LPL est directement impliquée dans l'élimination des acides gras du sang et les stocke ensuite dans les adipocytes et/ou les fournit aux tissus musculaires squelettiques pour le carburant. Ainsi, si la LPL peut être supprimée dans les tissus adipeux, on pourrait spéculer que moins de substrats gras seront activement stockés (ré-estérifiés) et plus seront disponibles pour alimenter les processus métaboliques.
Des études menées sur des adipocytes humains en culture ont montré que la GH n'a en fait aucun effet direct sur la lipolyse [18], mais elle augmente considérablement la sensibilité aux catécholamines dans ces cellules, suggérant que la GH active la lipolyse à un stade après l'implication des récepteurs bêta-adrénergiques et/ou des protéines G. En fait, il est raisonnable de spéculer que la GH pourrait augmenter la densité des récepteurs bêta-adrénergiques, ce qui pourrait potentiellement devenir très intéressant. Il a déjà été démontré précédemment qu'il existe des récepteurs bêta-adrénergiques "en réserve" sur les adipocytes humains et une augmentation aiguë du nombre de récepteurs couplés augmenterait la sensibilité et finalement le potentiel lipolytique [19]. De plus, chez les modèles animaux, il a été démontré que la GH augmentait spécifiquement l'expression des récepteurs β3-adrénergiques dans les adipocytes, suivie de l'activation de HSL [20]. Ainsi, en plus des effets directement médiés par la GH, il est logique de penser que l'utilisation d'un agoniste bêta-adrénergique pourrait très probablement créer un effet additif sur le processus lipolytique.

TAUX MAXIMAL DE LIPOLYSE
Donc, alors que nous travaillons à créer une pile qui maximise le potentiel lipolytique, y a-t-il une limite réelle (ou théorique) à la vitesse à laquelle elle se produira ? En fait, nous avons une réponse ; du moins en ce qui concerne uniquement le taux maximal auquel la GH administrée par voie intraveineuse peut provoquer la lipolyse [21]. On a constaté que cela correspondait à une dose d'environ 3 µg/kg (correspondant à une concentration moyenne de GH de pointe de 32,4 µg/litre). La dose n'était pas dépendante de l'âge ni du sexe et correspond à peu près à l'équivalent de 1,2 à 1,5 UI pour un homme maigre de 100 kg. Une dose supérieure à cela n'entraîne pas en réalité un impact plus important sur la lipolyse. Il se trouve simplement que c'est aussi essentiellement la limite supérieure des rafales sécrétoires endogènes naturelles [22]. On suppose que cela pourrait être une limitation, ou un goulot d'étranglement, causé en partie par les taux de clairance extra-rénale associés aux niveaux circulants de GHBP [23].
Il y a des preuves que c'est un goulot d'étranglement spécifique à la GH, et que les traitements combinés avec des variants de catécholamines produisent un effet additif sur la lipolyse, supérieur à chaque traitement pris individuellement [24-27], ce qui conforte davantage l'idée que la GH est un médiateur de la lipolyse. Certains ont qualifié cela d'effet permissif sur la lipolyse induite par les catécholamines [28]. De manière anecdotique, il semble que la GH associée à la présence de composés stimulant les catécholamines [29] ait un effet additif les uns sur les autres. Et nous approfondirons un peu cela plus tard dans l'article.
La pharmacocinétique concerne la manière dont une substance administrée se déplace dans le corps (par exemple, l'absorption, la distribution et l'excrétion), et la pharmacodynamique concerne les effets qu'une substance administrée a sur le corps [30]. Il est très important de comprendre les deux, en ce qui concerne la GH, afin de maximiser pleinement son potentiel lipolytique, d'optimiser la GH administrée et d'éviter les conceptions de protocoles mal configurées. L'acquisition de GH peut souvent être coûteuse, il serait donc dans notre intérêt de ne pas la gaspiller.
Les voies d'administration modifient considérablement la pharmacocinétique de la GH. Comme discuté précédemment, la GH endogène est sécrétée de manière pulsatile, avec sa présence dans le sérum éliminée rapidement via les rétroactions de régulation négatives naturelles du corps. Pour imiter au mieux ce comportement sécrétoire, il faudrait utiliser l'administration intraveineuse toutes les 2 à 3 heures, soit la durée nécessaire à l'élimination de la rétroaction ultra-courte (GHRH inhibant sa propre sécrétion). Cependant, à moins d'être supervisé par un médecin, ce n'est pas quelque chose que j'encourage ou que je soutiens, et cet article se concentrera donc sur les deux méthodes d'administration de GH les plus couramment utilisées : sous-cutanée et intramusculaire.
Je vais en fait joindre à la fin de cet article un graphique provenant d'une étude très bien conçue [31] comparant les propriétés pharmacodynamiques et pharmacocinétiques de diverses doses de GH chez les hommes et les femmes bien entraînés. Dans l'étude, le groupe de sujets à "haute dose" recevait l'équivalent d'environ 20 à 25 UI de Humatrope, ce qui est bien supérieur à ce que la plupart des culturistes avancés utiliseraient même en rêve. L'aspect le plus frappant des données présentées était la différence de réponse entre les hommes aux doses administrées par voie intramusculaire (IM) par rapport à celles administrées par voie sous-cutanée (SC). Le groupe de sujets masculins administrés par voie IM avait un pic de GH significativement plus élevé malgré des doses identiques au groupe SC. En fait, le groupe masculin IM atteignait un pic presque aussi élevé que le groupe SC à haute dose, bien qu'il ait reçu moins de la moitié de la quantité de GH injectée. En revanche, le groupe SC avait des niveaux de GH sérique élevés pendant une durée globale plus longue, ce qui a également été rapporté précédemment [32]. Ces données sont intrigantes ; cependant, des essais ont démontré que les échéanciers associés à la lipolyse se produisent de manière presque identique, indépendamment de l'utilisation de l'administration IM ou SC [18].
Suite à des injections de GH, qu'elles soient SC ou IM, les niveaux plasmatiques d'AG libres et de glycérol augmentent après une brève période de latence, les taux de mobilisation des graisses atteignant leur maximum vers 150-160 minutes.
Un autre point majeur à identifier concerne le moment de l'injection de GH. L'état de jeûne est associé non seulement à une augmentation prononcée de la sécrétion de GH endogène, comme détaillé précédemment, mais aussi à une sensibilité lipolytique accrue à l'administration exogène de GH [33]. En fait, tous les marqueurs de lipolyse sont améliorés lorsque la GH est administrée à jeun par rapport à l'administration dans l'état digestif/postprandial [34]. Le taux global de clairance est également nettement augmenté tout en restant à jeun.
Il est également important de noter que l'administration de GH le soir a montré une biodisponibilité plus élevée, du moins lorsqu'elle est administrée à des sujets déficients en hormone de croissance (GHD) [35]. Cela pourrait être dû au fait qu'elle imite plus étroitement la libération endogène naturelle en soirée, mais cela relève en grande partie de la spéculation à ce stade.
SYNERGIES DE COMPOSÉS
Lors de la conception d'une pile de perte de graisse visant à maximiser le potentiel lipolytique, il serait bon de choisir des composés ayant une synergie potentielle ou des effets additifs les uns sur les autres. Plus tôt, nous avons discuté de certains mécanismes de haut niveau par lesquels la GH induit ses effets lipolytiques. L'une de ses voies clés implique les récepteurs bêta-adrénergiques. Il semblerait donc plausible que si nous pouvons augmenter la sensibilité et/ou l'expression de la voie bêta, nous pouvons optimiser davantage la réponse lipolytique globale de notre pile.
Les androgènes induisent directement des effets lipolytiques puissants via les récepteurs d'androgènes exprimés dans les tissus adipeux [36]. C'est intéressant en soi, car c'est un chemin différent de celui utilisé par la GH, cependant les androgènes ont également montré qu'ils augmentaient l'expression des récepteurs bêta-adrénergiques [37-38]. J'ai déjà expliqué comment augmenter le nombre de récepteurs couplés dans les adipocytes pourrait augmenter la sensibilité et potentiellement le potentiel lipolytique, ce qui pourrait être une synergie puissante dans les méthodologies de conception de pile.
L'axe thyroïdien et l'axe GH/IGF ont une relation très intéressante, bien que compliquée, entre eux. Ce qui intéresse particulièrement la conception de pile lipolytique, c'est son impact sur l'ARNm des récepteurs bêta-adrénergiques et plus précisément son impact sur l'expression de β3, qui s'est avéré être une étape critique dans la lipolyse induite par la GH [39-41]. De plus, les hormones thyroïdiennes stimulent la synthèse, la dégradation et la mobilisation des lipides, ce qui entraîne une
augmentation des taux de AG circulants [42]. Et la dernière caractéristique synergique digne de mention est qu'ils, tout comme la GH, semblent réguler la sensibilité des processus métaboliques aux catécholamines.
Et une fois que vous avez cette sensibilité et densité accrues des récepteurs bêta-adrénergiques, il est logique de penser qu'un agoniste bêta-adrénergique serait la cerise sur le gâteau pour maximiser pleinement le potentiel de mobilisation des graisses. Le clenbutérol [42] est un excellent candidat pour l'ajout à la pile ici ; cependant, une revue exhaustive des agonistes bêta-adrénergiques dépasse le cadre de cet article.
APPLICATIONS PRATIQUES
Maintenant que nous avons mis de côté toutes les informations de base, comment concevoir un cycle et administrer les hormones ?
Je pense qu'il est assez évident qu'il faudra être à jeun lors de la prise de GH. Bien que les effets lipolytiques de la rHGH ne soient pas complètement neutralisés en présence de nourriture (contrairement à la GH endogène), on ferait un sérieux déservice en ne suivant pas cette directive.
En utilisant les lignes directrices du jeûne, ainsi qu'une dose conçue pour provoquer une réponse lipolytique maximale, on obtiendrait une injection unique de 2 UI de GH. Cela conviendrait très bien de le faire au réveil le matin, car nous serions déjà en état de jeûne, très probablement. Étant donné que les injections sous-cutanées ont un temps de clairance plus long, ce serait une bonne méthode à utiliser pour l'injection, en particulier si l'on prévoit de rester à jeun pendant de nombreuses heures après l'injection. Pour un effet additif potentiel sur les taux de mobilisation des graisses, je recommanderais également d'effectuer une activité structurée (sous forme de LISS ou d'entraînement en résistance) pendant cette fenêtre de jeûne [44].
En suivant les mêmes lignes directrices, il serait tout à fait possible d'administrer une deuxième injection de 2 UI de GH avant d'aller se coucher, à condition d'avoir pu consommer tous ses repas dans un laps de temps condensé et d'entrer dans les heures du soir dans un état de semi-jeûne. Comme illustré plus tôt dans l'article, il existe même des preuves que l'administration sous-cutanée le soir offre une biodisponibilité plus élevée. Donc, si l'on est contraint de choisir entre le matin et le soir, c'est l'heure de dosage que je recommanderais. Sinon, l'utilisation d'une stratégie d'injection de 2 UI à la fois le matin et le soir pourrait théoriquement maximiser le potentiel lipolytique sur une période de 24 heures, à condition de respecter les bonnes directives de jeûne.
En utilisant ce protocole de dosage de GH, en concert avec une pile d'androgènes, on peut améliorer le potentiel global de perte de graisse. On devrait envisager des AAS supraphysiologiques pour cette raison, ainsi que pour éviter le risque d'atrophie des tissus maigres pendant les périodes de déficit d'apport soutenu. Il peut y avoir des différences mineures dans la vitesse de perte de graisse produite par l'utilisation de différents types d'androgènes, mais cela dépasse le cadre de cet article. Même une conception simple de pile d'AAS à base de testostérone fonctionnerait très bien ici.
L'ajout à la pile à la fois de la thyroïde exogène et du clenbutérol maximisera davantage le potentiel lipolytique global en fonction de leurs propriétés synergiques avec les androgènes et la GH, expliquées dans l'article. En raison de leurs propriétés respectives, le clenbutérol peut être dosé une fois par jour, tout comme la T4. Pour ceux qui utilisent la T3, je recommande un minimum de deux doses par jour, espacées de 12 heures.
Pour résumer tout cela de manière simple et concise, voici un bref aperçu :
- Pile d'AAS supraphysiologiques
- Clenbutérol + Thyroïde
- GH administrée par voie sous-cutanée à une dose ne dépassant pas 2 UI à l'état de jeûne (matin/soir) ou le soir si nécessaire
- Activité structurée effectuée à jeun, après l'injection, pour renforcer le potentiel de mobilisation des graisses.
REFERENCES
1. National Research Council (US) Committee on Technological Options to Improve the Nutritional Attributes of Animal Products. Designing Foods: Animal Product Options in the Marketplace. Washington (DC): National Academies Press (US); 1988. The Role of Growth Hormone in Fat Mobilization
2. Lee, M. O., and Schaffer, N. K.: Anterior Pituitary Growth Hormone and the Composition of Growth , J. Nutrition 7: 337 ( (March 10) ) 1934.
3. Li CH, Evans HM, Simpson ME. Isolation and properties of the anterior hypophyseal growth hormone. J Biol Chem. 1945;159:353–366.
4. Schoemaker RC, Buijs MM, Pijl H, Burggraaf J, Cohen AF. Modeling the influence of growth hormone on lipolysis. J Pharmacokinet Pharmacodyn. 2002 Apr;29(2):157-70
5. Lass A, Zimmermann R, Oberer M, Zechner R. Lipolysis – A highly regulated multi-enzyme complex mediates the catabolism of cellular fat stores. Progress in Lipid Research. 2011;50(1-4):14-27.
6. ROTH J, GLICK SM, YALOW RS, BERSON SA. Secretion of human growth hormone hysiologic and experimental modification. Metabolism. 1963 Jul;12:577-9
hysiologic and experimental modification. Metabolism. 1963 Jul;12:577-9
7. Hartman ML, Veldhuis JD, Johnson ML, Lee MM, Alberti KG, Samojlik E, Thorner MO. Augmented growth hormone (GH) secretory burst frequency and amplitude mediate enhanced GH secretion during a two-day fast in normal men. J Clin Endocrinol Metab. 1992 Apr;74(4):757-65.
8. Ho PJ, Friberg RD, Barkan AL. Regulation of pulsatile growth hormone secretion by fasting in normal subjects and patients with acromegaly. J Clin Endocrinol Metab. 1992 Sep;75(3):812-9.
9. Goldenberg N, Barkan A. Factors regulating growth hormone secretion in humans. Endocrinol Metab Clin North Am. 2007 Mar;36(1):37-55. Review
10. Berg JM, Tymoczko JL, Stryer L. Biochemistry. 5th edition. New York: W H Freeman; 2002. Section 30.3, Food Intake and Starvation Induce Metabolic Changes.
11. Nørrelund H. The metabolic role of growth hormone in humans with particular reference to fasting. Growth Horm IGF Res. 2005 Apr;15(2):95-122. Review.
12. Birnbaum MJ. Lipolysis: more than just a lipase. J Cell Biol. 2003 Jun 23;161(6):1011-2. Epub 2003 Jun 16. Review.
13. Pedersen, S.B. & Børglum, Jens & Jorgensen, Jens & Richelsen, Bjørn. (1995). Growth hormone treatment of obese premenopausal women: Effects on isolated adipocyte metabolism. 2. 251-258.
14. Slavin BG, Ong JM, Kern PA. Hormonal regulation of hormone-sensitive lipase activity and mRNA levels in isolated rat adipocytes. J Lipid Res. 1994 Sep;35(9):1535-41.
15. Ottosson M, Vikman-Adolfsson K, Enerbäck S, Elander A, Björntorp P, Edén S. Growth hormone inhibits lipoprotein lipase activity in human adipose tissue. J Clin Endocrinol Metab. 1995 Mar;80(3):936-41.
16. Richelsen B. Effect of growth hormone on adipose tissue and skeletal muscle lipoprotein lipase activity in humans. J Endocrinol Invest. 1999;22(5 Suppl):10-5. Review.
17. Richelsen B, Pedersen SB, Kristensen K, Børglum JD, Nørrelund H, Christiansen JS, Jørgensen JO. Regulation of lipoprotein lipase and hormone-sensitive lipase activity and gene expression in adipose and muscle tissue by growth hormone treatment during weight loss in obese patients. Metabolism. 2000 Jul;49(7):906-11.
18. Marcus C, Margery V, Kamel A, Brönnegård M. Effects of growth hormone on lipolysis in humans. Acta Paediatr Suppl. 1994 Dec;406:54-8; discussion 59. Review.
19. Arner P, Hellmér J, Wennlund A, Ostman J, Engfeldt P. Adrenoceptor occupancy in isolated human fat cells and its relationship with lipolysis rate. Eur J Pharmacol. 1988 Jan 27;146(1):45-56
20. Heffernan M, Summers RJ, Thorburn A, Ogru E, Gianello R, Jiang WJ, Ng FM. The effects of human GH and its lipolytic fragment (AOD9604) on lipid metabolism following chronic treatment in obese mice and beta(3)-AR knock-out mice. Endocrinology. 2001 Dec;142(12):5182-9.
21. Hansen TK, Gravholt CH, ØRskov H, Rasmussen MH, Christiansen JS, Jørgensen JO. Dose dependency of the pharmacokinetics and acute lipolytic actions of growth hormone. J Clin Endocrinol Metab. 2002 Oct;87(10):4691-8
22. Hartman ML, Faria AC, Vance ML, Johnson ML, Thorner MO, Veldhuis JD. Temporal structure of in vivo growth hormone secretory events in humans. Am J Physiol. 1991 Jan;260
23. Haffner D, Schaefer F, Girard J, Ritz E, Mehls O 1994 Metabolic clearance of recombinant human growth hormone in health and chronic renal failure. J Clin Invest 93:1163–1171
24. Fain JN. Effect of dibutyryl-3′,5′-AMP, theophylline and norepinephrine on lipolytic action of growth hormone and glucocorticoid in white fat cells. Endocrinology. 1968 Apr;82(4):825-30.
25. Goodman HM. Effects of growth hormone on the lipolytic response of adipose tissue to theophylline. Endocrinology. 1968 May;82(5):1027-34.
26. Yip RG, Goodman HM. Growth hormone and dexamethasone stimulate lipolysis and activate adenylyl cyclase in rat adipocytes by selectively shifting Gi alpha2 to lower density membrane fractions. Endocrinology. 1999 Mar;140(3):1219-27.
27. Fain JN, Cheema P, Tichansky DS, Madan AK. Stimulation of human omental adipose tissue lipolysis by growth hormone plus dexamethasone. Mol Cell Endocrinol. 2008 Nov 25;295(1-2):101-5.
28. Goodman HM 1970 Permissive effects of hormones on lipolysis. Endocrinology 86:1064–1074
29. Davis E, Loiacono R, Summers RJ. The rush to adrenaline: drugs in sport acting on the β-adrenergic system. British Journal of Pharmacology. 2008;154(3):584-597
30. Greenblatt, D. J. and Abourjaily, P. N. (2016), Pharmacokinetics and Pharmacodynamics for Medical Students: A Proposed Course Outline. The Journal of Clinical Pharmacology, 56: 1180–1195.
31. Keller A, Wu Z, Kratzsch J, Keller E, Blum WF, Kniess A, Preiss R, Teichert J, Strasburger CJ, Bidlingmaier M. Pharmacokinetics and pharmacodynamics of GH:dependence on route and dosage of administration. Eur J Endocrinol. 2007 Jun;156(6):647-53
32. Laursen T. Clinical pharmacological aspects of growth hormone administration. Growth Horm IGF Res. 2004 Feb;14(1):16-44. Review.
33. Møller N, Pørksen N, Ovesen P, Alberti KG. Evidence for increased sensitivity of fuel mobilization to growth hormone during short-term fasting in humans. Horm Metab Res. 1993 Mar;25(3):175-9.
34. Moller L, Dalman L, Norrelund H, Billestrup N, Frystyk J, Moller N, Jorgensen JO. Impact of fasting on growth hormone signaling and action in muscle and fat. J Clin Endocrinol Metab. 2009 Mar;94(3):965-72
35. Jørgensen JO, Møller N, Lauritzen T, Alberti KG, Orskov H, Christiansen JS. Evening versus morning injections of growth hormone (GH) in GH-deficient patients: effects on 24-hour patterns of circulating hormones and metabolites. J Clin Endocrinol Metab. 1990 Jan;70(1):207-14.
36. Blouin K, Veilleux A, Luu-The V, Tchernof A. Androgen metabolism in adipose tissue: recent advances. Mol Cell Endocrinol. 2009 Mar 25;301(1-2):97-103
37. Xu X, De Pergola G, Björntorp P. The effects of androgens on the regulation of lipolysis in adipose precursor cells. Endocrinology. 1990 Feb;126(2):1229-34
38. De Pergola G. The adipose tissue metabolism: role of testosterone and dehydroepiandrosterone. Int J Obes Relat Metab Disord. 2000 Jun;24 Suppl 2:S59-63. Review
39. Viguerie N, Millet L, Avizou S, Vidal H, Larrouy D, Langin D. Regulation of human adipocyte gene expression by thyroid hormone. J Clin Endocrinol Metab. 2002 Feb;87(2):630-4
40. Rubio A, Raasmaja A, Silva JE. Thyroid hormone and norepinephrine signaling in brown adipose tissue. II: Differential effects of thyroid hormone on beta 3-adrenergic receptors in brown and white adipose tissue. Endocrinology. 1995 Aug;136(8):3277-84.
41. Ghosh M, Das S. Increased beta(2)-adrenergic receptor activity by thyroid hormone possibly leads to differentiation and maturation of astrocytes in culture. Cell Mol Neurobiol. 2007 Dec;27(8):1007-21. Epub 2007 Sep 8
42. Pucci E, Chiovato L, Pinchera A. Thyroid and lipid metabolism. Int J Obes Relat Metab Disord. 2000 Jun;24 Suppl 2:S109-12. Review
43. Kim HK, Della-Fera MA, Hausman DB, Baile CA. Effect of clenbuterol on apoptosis, adipogenesis, and lipolysis in adipocytes. J Physiol Biochem. 2010 Sep;66(3):197-203
44. Taaffe DR, Thompson JL, Butterfield GE, Hoffman AR, Marcus R. Recombinant human growth hormone, but not insulin-like growth factor-I, enhances central fat loss in postmenopausal women undergoing a diet and exercise program. Horm
Metab Res. 2001 Mar;33(3):156-62.
Source
Les voies d'administration modifient considérablement la pharmacocinétique de la GH. Comme discuté précédemment, la GH endogène est sécrétée de manière pulsatile, avec sa présence dans le sérum éliminée rapidement via les rétroactions de régulation négatives naturelles du corps. Pour imiter au mieux ce comportement sécrétoire, il faudrait utiliser l'administration intraveineuse toutes les 2 à 3 heures, soit la durée nécessaire à l'élimination de la rétroaction ultra-courte (GHRH inhibant sa propre sécrétion). Cependant, à moins d'être supervisé par un médecin, ce n'est pas quelque chose que j'encourage ou que je soutiens, et cet article se concentrera donc sur les deux méthodes d'administration de GH les plus couramment utilisées : sous-cutanée et intramusculaire.
Je vais en fait joindre à la fin de cet article un graphique provenant d'une étude très bien conçue [31] comparant les propriétés pharmacodynamiques et pharmacocinétiques de diverses doses de GH chez les hommes et les femmes bien entraînés. Dans l'étude, le groupe de sujets à "haute dose" recevait l'équivalent d'environ 20 à 25 UI de Humatrope, ce qui est bien supérieur à ce que la plupart des culturistes avancés utiliseraient même en rêve. L'aspect le plus frappant des données présentées était la différence de réponse entre les hommes aux doses administrées par voie intramusculaire (IM) par rapport à celles administrées par voie sous-cutanée (SC). Le groupe de sujets masculins administrés par voie IM avait un pic de GH significativement plus élevé malgré des doses identiques au groupe SC. En fait, le groupe masculin IM atteignait un pic presque aussi élevé que le groupe SC à haute dose, bien qu'il ait reçu moins de la moitié de la quantité de GH injectée. En revanche, le groupe SC avait des niveaux de GH sérique élevés pendant une durée globale plus longue, ce qui a également été rapporté précédemment [32]. Ces données sont intrigantes ; cependant, des essais ont démontré que les échéanciers associés à la lipolyse se produisent de manière presque identique, indépendamment de l'utilisation de l'administration IM ou SC [18].
Suite à des injections de GH, qu'elles soient SC ou IM, les niveaux plasmatiques d'AG libres et de glycérol augmentent après une brève période de latence, les taux de mobilisation des graisses atteignant leur maximum vers 150-160 minutes.
Un autre point majeur à identifier concerne le moment de l'injection de GH. L'état de jeûne est associé non seulement à une augmentation prononcée de la sécrétion de GH endogène, comme détaillé précédemment, mais aussi à une sensibilité lipolytique accrue à l'administration exogène de GH [33]. En fait, tous les marqueurs de lipolyse sont améliorés lorsque la GH est administrée à jeun par rapport à l'administration dans l'état digestif/postprandial [34]. Le taux global de clairance est également nettement augmenté tout en restant à jeun.
Il est également important de noter que l'administration de GH le soir a montré une biodisponibilité plus élevée, du moins lorsqu'elle est administrée à des sujets déficients en hormone de croissance (GHD) [35]. Cela pourrait être dû au fait qu'elle imite plus étroitement la libération endogène naturelle en soirée, mais cela relève en grande partie de la spéculation à ce stade.
SYNERGIES DE COMPOSÉS
Lors de la conception d'une pile de perte de graisse visant à maximiser le potentiel lipolytique, il serait bon de choisir des composés ayant une synergie potentielle ou des effets additifs les uns sur les autres. Plus tôt, nous avons discuté de certains mécanismes de haut niveau par lesquels la GH induit ses effets lipolytiques. L'une de ses voies clés implique les récepteurs bêta-adrénergiques. Il semblerait donc plausible que si nous pouvons augmenter la sensibilité et/ou l'expression de la voie bêta, nous pouvons optimiser davantage la réponse lipolytique globale de notre pile.
Les androgènes induisent directement des effets lipolytiques puissants via les récepteurs d'androgènes exprimés dans les tissus adipeux [36]. C'est intéressant en soi, car c'est un chemin différent de celui utilisé par la GH, cependant les androgènes ont également montré qu'ils augmentaient l'expression des récepteurs bêta-adrénergiques [37-38]. J'ai déjà expliqué comment augmenter le nombre de récepteurs couplés dans les adipocytes pourrait augmenter la sensibilité et potentiellement le potentiel lipolytique, ce qui pourrait être une synergie puissante dans les méthodologies de conception de pile.
L'axe thyroïdien et l'axe GH/IGF ont une relation très intéressante, bien que compliquée, entre eux. Ce qui intéresse particulièrement la conception de pile lipolytique, c'est son impact sur l'ARNm des récepteurs bêta-adrénergiques et plus précisément son impact sur l'expression de β3, qui s'est avéré être une étape critique dans la lipolyse induite par la GH [39-41]. De plus, les hormones thyroïdiennes stimulent la synthèse, la dégradation et la mobilisation des lipides, ce qui entraîne une
augmentation des taux de AG circulants [42]. Et la dernière caractéristique synergique digne de mention est qu'ils, tout comme la GH, semblent réguler la sensibilité des processus métaboliques aux catécholamines.
Et une fois que vous avez cette sensibilité et densité accrues des récepteurs bêta-adrénergiques, il est logique de penser qu'un agoniste bêta-adrénergique serait la cerise sur le gâteau pour maximiser pleinement le potentiel de mobilisation des graisses. Le clenbutérol [42] est un excellent candidat pour l'ajout à la pile ici ; cependant, une revue exhaustive des agonistes bêta-adrénergiques dépasse le cadre de cet article.

APPLICATIONS PRATIQUES
Maintenant que nous avons mis de côté toutes les informations de base, comment concevoir un cycle et administrer les hormones ?
Je pense qu'il est assez évident qu'il faudra être à jeun lors de la prise de GH. Bien que les effets lipolytiques de la rHGH ne soient pas complètement neutralisés en présence de nourriture (contrairement à la GH endogène), on ferait un sérieux déservice en ne suivant pas cette directive.
En utilisant les lignes directrices du jeûne, ainsi qu'une dose conçue pour provoquer une réponse lipolytique maximale, on obtiendrait une injection unique de 2 UI de GH. Cela conviendrait très bien de le faire au réveil le matin, car nous serions déjà en état de jeûne, très probablement. Étant donné que les injections sous-cutanées ont un temps de clairance plus long, ce serait une bonne méthode à utiliser pour l'injection, en particulier si l'on prévoit de rester à jeun pendant de nombreuses heures après l'injection. Pour un effet additif potentiel sur les taux de mobilisation des graisses, je recommanderais également d'effectuer une activité structurée (sous forme de LISS ou d'entraînement en résistance) pendant cette fenêtre de jeûne [44].
En suivant les mêmes lignes directrices, il serait tout à fait possible d'administrer une deuxième injection de 2 UI de GH avant d'aller se coucher, à condition d'avoir pu consommer tous ses repas dans un laps de temps condensé et d'entrer dans les heures du soir dans un état de semi-jeûne. Comme illustré plus tôt dans l'article, il existe même des preuves que l'administration sous-cutanée le soir offre une biodisponibilité plus élevée. Donc, si l'on est contraint de choisir entre le matin et le soir, c'est l'heure de dosage que je recommanderais. Sinon, l'utilisation d'une stratégie d'injection de 2 UI à la fois le matin et le soir pourrait théoriquement maximiser le potentiel lipolytique sur une période de 24 heures, à condition de respecter les bonnes directives de jeûne.
En utilisant ce protocole de dosage de GH, en concert avec une pile d'androgènes, on peut améliorer le potentiel global de perte de graisse. On devrait envisager des AAS supraphysiologiques pour cette raison, ainsi que pour éviter le risque d'atrophie des tissus maigres pendant les périodes de déficit d'apport soutenu. Il peut y avoir des différences mineures dans la vitesse de perte de graisse produite par l'utilisation de différents types d'androgènes, mais cela dépasse le cadre de cet article. Même une conception simple de pile d'AAS à base de testostérone fonctionnerait très bien ici.
L'ajout à la pile à la fois de la thyroïde exogène et du clenbutérol maximisera davantage le potentiel lipolytique global en fonction de leurs propriétés synergiques avec les androgènes et la GH, expliquées dans l'article. En raison de leurs propriétés respectives, le clenbutérol peut être dosé une fois par jour, tout comme la T4. Pour ceux qui utilisent la T3, je recommande un minimum de deux doses par jour, espacées de 12 heures.
Pour résumer tout cela de manière simple et concise, voici un bref aperçu :
- Pile d'AAS supraphysiologiques
- Clenbutérol + Thyroïde
- GH administrée par voie sous-cutanée à une dose ne dépassant pas 2 UI à l'état de jeûne (matin/soir) ou le soir si nécessaire
- Activité structurée effectuée à jeun, après l'injection, pour renforcer le potentiel de mobilisation des graisses.
REFERENCES
1. National Research Council (US) Committee on Technological Options to Improve the Nutritional Attributes of Animal Products. Designing Foods: Animal Product Options in the Marketplace. Washington (DC): National Academies Press (US); 1988. The Role of Growth Hormone in Fat Mobilization
2. Lee, M. O., and Schaffer, N. K.: Anterior Pituitary Growth Hormone and the Composition of Growth , J. Nutrition 7: 337 ( (March 10) ) 1934.
3. Li CH, Evans HM, Simpson ME. Isolation and properties of the anterior hypophyseal growth hormone. J Biol Chem. 1945;159:353–366.
4. Schoemaker RC, Buijs MM, Pijl H, Burggraaf J, Cohen AF. Modeling the influence of growth hormone on lipolysis. J Pharmacokinet Pharmacodyn. 2002 Apr;29(2):157-70
5. Lass A, Zimmermann R, Oberer M, Zechner R. Lipolysis – A highly regulated multi-enzyme complex mediates the catabolism of cellular fat stores. Progress in Lipid Research. 2011;50(1-4):14-27.
6. ROTH J, GLICK SM, YALOW RS, BERSON SA. Secretion of human growth hormone
7. Hartman ML, Veldhuis JD, Johnson ML, Lee MM, Alberti KG, Samojlik E, Thorner MO. Augmented growth hormone (GH) secretory burst frequency and amplitude mediate enhanced GH secretion during a two-day fast in normal men. J Clin Endocrinol Metab. 1992 Apr;74(4):757-65.
8. Ho PJ, Friberg RD, Barkan AL. Regulation of pulsatile growth hormone secretion by fasting in normal subjects and patients with acromegaly. J Clin Endocrinol Metab. 1992 Sep;75(3):812-9.
9. Goldenberg N, Barkan A. Factors regulating growth hormone secretion in humans. Endocrinol Metab Clin North Am. 2007 Mar;36(1):37-55. Review
10. Berg JM, Tymoczko JL, Stryer L. Biochemistry. 5th edition. New York: W H Freeman; 2002. Section 30.3, Food Intake and Starvation Induce Metabolic Changes.
11. Nørrelund H. The metabolic role of growth hormone in humans with particular reference to fasting. Growth Horm IGF Res. 2005 Apr;15(2):95-122. Review.
12. Birnbaum MJ. Lipolysis: more than just a lipase. J Cell Biol. 2003 Jun 23;161(6):1011-2. Epub 2003 Jun 16. Review.
13. Pedersen, S.B. & Børglum, Jens & Jorgensen, Jens & Richelsen, Bjørn. (1995). Growth hormone treatment of obese premenopausal women: Effects on isolated adipocyte metabolism. 2. 251-258.
14. Slavin BG, Ong JM, Kern PA. Hormonal regulation of hormone-sensitive lipase activity and mRNA levels in isolated rat adipocytes. J Lipid Res. 1994 Sep;35(9):1535-41.
15. Ottosson M, Vikman-Adolfsson K, Enerbäck S, Elander A, Björntorp P, Edén S. Growth hormone inhibits lipoprotein lipase activity in human adipose tissue. J Clin Endocrinol Metab. 1995 Mar;80(3):936-41.
16. Richelsen B. Effect of growth hormone on adipose tissue and skeletal muscle lipoprotein lipase activity in humans. J Endocrinol Invest. 1999;22(5 Suppl):10-5. Review.
17. Richelsen B, Pedersen SB, Kristensen K, Børglum JD, Nørrelund H, Christiansen JS, Jørgensen JO. Regulation of lipoprotein lipase and hormone-sensitive lipase activity and gene expression in adipose and muscle tissue by growth hormone treatment during weight loss in obese patients. Metabolism. 2000 Jul;49(7):906-11.
18. Marcus C, Margery V, Kamel A, Brönnegård M. Effects of growth hormone on lipolysis in humans. Acta Paediatr Suppl. 1994 Dec;406:54-8; discussion 59. Review.
19. Arner P, Hellmér J, Wennlund A, Ostman J, Engfeldt P. Adrenoceptor occupancy in isolated human fat cells and its relationship with lipolysis rate. Eur J Pharmacol. 1988 Jan 27;146(1):45-56
20. Heffernan M, Summers RJ, Thorburn A, Ogru E, Gianello R, Jiang WJ, Ng FM. The effects of human GH and its lipolytic fragment (AOD9604) on lipid metabolism following chronic treatment in obese mice and beta(3)-AR knock-out mice. Endocrinology. 2001 Dec;142(12):5182-9.
21. Hansen TK, Gravholt CH, ØRskov H, Rasmussen MH, Christiansen JS, Jørgensen JO. Dose dependency of the pharmacokinetics and acute lipolytic actions of growth hormone. J Clin Endocrinol Metab. 2002 Oct;87(10):4691-8
22. Hartman ML, Faria AC, Vance ML, Johnson ML, Thorner MO, Veldhuis JD. Temporal structure of in vivo growth hormone secretory events in humans. Am J Physiol. 1991 Jan;260
23. Haffner D, Schaefer F, Girard J, Ritz E, Mehls O 1994 Metabolic clearance of recombinant human growth hormone in health and chronic renal failure. J Clin Invest 93:1163–1171
24. Fain JN. Effect of dibutyryl-3′,5′-AMP, theophylline and norepinephrine on lipolytic action of growth hormone and glucocorticoid in white fat cells. Endocrinology. 1968 Apr;82(4):825-30.
25. Goodman HM. Effects of growth hormone on the lipolytic response of adipose tissue to theophylline. Endocrinology. 1968 May;82(5):1027-34.
26. Yip RG, Goodman HM. Growth hormone and dexamethasone stimulate lipolysis and activate adenylyl cyclase in rat adipocytes by selectively shifting Gi alpha2 to lower density membrane fractions. Endocrinology. 1999 Mar;140(3):1219-27.
27. Fain JN, Cheema P, Tichansky DS, Madan AK. Stimulation of human omental adipose tissue lipolysis by growth hormone plus dexamethasone. Mol Cell Endocrinol. 2008 Nov 25;295(1-2):101-5.
28. Goodman HM 1970 Permissive effects of hormones on lipolysis. Endocrinology 86:1064–1074
29. Davis E, Loiacono R, Summers RJ. The rush to adrenaline: drugs in sport acting on the β-adrenergic system. British Journal of Pharmacology. 2008;154(3):584-597
30. Greenblatt, D. J. and Abourjaily, P. N. (2016), Pharmacokinetics and Pharmacodynamics for Medical Students: A Proposed Course Outline. The Journal of Clinical Pharmacology, 56: 1180–1195.
31. Keller A, Wu Z, Kratzsch J, Keller E, Blum WF, Kniess A, Preiss R, Teichert J, Strasburger CJ, Bidlingmaier M. Pharmacokinetics and pharmacodynamics of GH:dependence on route and dosage of administration. Eur J Endocrinol. 2007 Jun;156(6):647-53
32. Laursen T. Clinical pharmacological aspects of growth hormone administration. Growth Horm IGF Res. 2004 Feb;14(1):16-44. Review.
33. Møller N, Pørksen N, Ovesen P, Alberti KG. Evidence for increased sensitivity of fuel mobilization to growth hormone during short-term fasting in humans. Horm Metab Res. 1993 Mar;25(3):175-9.
34. Moller L, Dalman L, Norrelund H, Billestrup N, Frystyk J, Moller N, Jorgensen JO. Impact of fasting on growth hormone signaling and action in muscle and fat. J Clin Endocrinol Metab. 2009 Mar;94(3):965-72
35. Jørgensen JO, Møller N, Lauritzen T, Alberti KG, Orskov H, Christiansen JS. Evening versus morning injections of growth hormone (GH) in GH-deficient patients: effects on 24-hour patterns of circulating hormones and metabolites. J Clin Endocrinol Metab. 1990 Jan;70(1):207-14.
36. Blouin K, Veilleux A, Luu-The V, Tchernof A. Androgen metabolism in adipose tissue: recent advances. Mol Cell Endocrinol. 2009 Mar 25;301(1-2):97-103
37. Xu X, De Pergola G, Björntorp P. The effects of androgens on the regulation of lipolysis in adipose precursor cells. Endocrinology. 1990 Feb;126(2):1229-34
38. De Pergola G. The adipose tissue metabolism: role of testosterone and dehydroepiandrosterone. Int J Obes Relat Metab Disord. 2000 Jun;24 Suppl 2:S59-63. Review
39. Viguerie N, Millet L, Avizou S, Vidal H, Larrouy D, Langin D. Regulation of human adipocyte gene expression by thyroid hormone. J Clin Endocrinol Metab. 2002 Feb;87(2):630-4
40. Rubio A, Raasmaja A, Silva JE. Thyroid hormone and norepinephrine signaling in brown adipose tissue. II: Differential effects of thyroid hormone on beta 3-adrenergic receptors in brown and white adipose tissue. Endocrinology. 1995 Aug;136(8):3277-84.
41. Ghosh M, Das S. Increased beta(2)-adrenergic receptor activity by thyroid hormone possibly leads to differentiation and maturation of astrocytes in culture. Cell Mol Neurobiol. 2007 Dec;27(8):1007-21. Epub 2007 Sep 8
42. Pucci E, Chiovato L, Pinchera A. Thyroid and lipid metabolism. Int J Obes Relat Metab Disord. 2000 Jun;24 Suppl 2:S109-12. Review
43. Kim HK, Della-Fera MA, Hausman DB, Baile CA. Effect of clenbuterol on apoptosis, adipogenesis, and lipolysis in adipocytes. J Physiol Biochem. 2010 Sep;66(3):197-203
44. Taaffe DR, Thompson JL, Butterfield GE, Hoffman AR, Marcus R. Recombinant human growth hormone, but not insulin-like growth factor-I, enhances central fat loss in postmenopausal women undergoing a diet and exercise program. Horm
Metab Res. 2001 Mar;33(3):156-62.
Source
