Introduction
Les hormones sexuelles jouent un rôle pivot dans le développement de la gynécomastie : l’hypertrophie bénigne du tissu mammaire chez les hommes. Il s’agit d’un effet secondaire esthétique déplaisant qui peut être dû à l’usage de stéroïdes anabolisants. C’est également très fréquent dans la population générale. Chez de nombreux hommes, la gynécomastie se développe en particulier pendant la puberté. Un manuel d’endocrinologie indique que cela apparaît initialement chez 60 à 70 % des garçons vers l’âge de 14 ans (puis régresse en 1 ou 2 ans) [1]. Chez les adultes, cette pathologie reste également assez prévalente. Une étude chez des hommes en bonne santé âgés de 18 à 26 ans a observé une gynécomastie chez 40,5 % de ces derniers [2]. Une autre étude est arrivée à des conclusions très similaires chez des hommes adultes en bonne santé âgés de 16 à 58 ans, détectant un tissu mammaire palpable chez 36 % de ces derniers [3]. Il faut préciser que, dans la plupart des cas (environ 80 % de ces derniers), le diamètre du tissu mammaire ne dépassait pas 4 cm. Donc dans ces cas, la gynécomastie n’est en général pas très importante.
L’usage de stéroïdes anabolisants et la gynécomastie
Donc, quelle est la fréquence de la gynécomastie suite à un usage de stéroïdes anabolisants ? Malheureusement, il est difficile de répondre à cette question. Aux Pays-Bas, un service de consultation externe pour les utilisateurs de stéroïdes anabolisants observe que parmi 160 de ses patients, 34 % ont déclaré une gynécomastie comme effet secondaire [4]. Cependant, il ne faut pas oublier l’existence d’un certain parti pris lors de l’évaluation de patients envoyés dans un tel service de consultation externe. Un certain biais de sélection est inévitable—après tout, il est peu probable que ceux qui présentent peu voire aucun effet secondaire en raison de leur usage de stéroïdes anabolisants soient envoyés dans un service de consultation externe. En outre, les effets secondaires étaient auto déclarés. Selon mon expérience une gynécomastie auto déclarée est peu fiable. De plus, comme chacun sait qu’il s’agit d’un effet secondaire de l’usage de stéroïdes anabolisants, les utilisateurs de SAA en ont davantage conscience et par conséquent sont plus susceptibles de détecter une gynécomastie déjà présente avant l’usage de stéroïdes anabolisants. Cela s’avère particulièrement vrai chez ceux qui perdent une certaine masse corporelle grasse pendant un cycle de stéroïdes anabolisants, car le tissu sous-jacent devient plus palpable et la gynécomastie est plus visible à l’œil nu. Enfin, j’ai également remarqué un petit nombre d’utilisateurs qui—parfois chaque jour—palpent leur tissu mammaire de manière assez maladroite, en le pinçant. Cela peut donner lieu à une inflammation du tissu sous-jacent, qui peut ressembler au toucher et à l’œil à une gynécomastie. Cette pratique peut également permettre d’expliquer en partie la galactorrhée (écoulement mammaire) qui semble s’observer rarement chez certains utilisateurs de SAA. Chacun sait que l’autopalpation des seins peut causer une galactorrhée [5].
Étudions certains essais contrôlés randomisés qui ont évalué les doses supraphysiologiques de testostérone. Bhasin et al. a randomisé 21 hommes pour recevoir 600 mg d’énanthate de testostérone par semaine, et 19 pour recevoir un placebo [6]. Deux hommes qui recevaient de la testostérone ont déclaré une sensibilité mammaire, mais aucune gynécomastie n‘a été déclarée. De même, un essai ultérieur de Bhasin et al. a randomisé des hommes à des doses croissantes d’énanthate de testostérone: 50, 125, 300 ou 600 mg par semaine pendant 20 semaines, avec ou sans dutastéride l’inhibiteur de la 5α-réductase [7]. Parmi les hommes recevant le dutastéride, un des douze hommes du groupe 300 mg a déclaré une sensibilité du mamelon, et un des quatorze hommes du groupe 600 mg a déclaré une sensibilité du mamelon. Parmi les hommes ne recevant pas de dutastéride, un des quinze hommes du groupe 600 mg a déclaré une sensibilité du mamelon. En résumé ; 3 des 53 hommes recevant une dose supraphysiologique (300 ou 600 mg par semaine) de testostérone pendant 20 semaines ont déclaré une sensibilité du mamelon. Et surtout, aucune gynécomastie n’a été déclarée. Cependant, il semblerait que les sujets n’étaient pas examinés régulièrement par un médecin en vue de rechercher une gynécomastie. Par conséquent, un petit développement du tissu mammaire peut être passé inaperçu. Dans un autre essai, 271 sujets ont reçu 200 mg d’énanthate de testostérone par semaine, pendant un minimum de 6 mois. Seuls 9 (3 %) de ces sujets ont développé une gynécomastie au cours du traitement. Dans l’ensemble, le risque de développer une gynécomastie manifeste au cours de la seule utilisation d’énanthate de testostérone en doses pouvant atteindre 600 mg par semaine semble relativement faible.
Malheureusement, il n’existe aucune donnée fiable relative aux doses supérieures à 600 mg par semaine, ou aux autres substances de doses supraphysiologiques. Cependant, attendu que l’action oestrogénique est une des causes à la source de la gynécomastie (nous y reviendrons ultérieurement), nous pouvons tirer quelques conclusions prudentes à propos des doses supérieures. Un essai élégant du groupe Bhasin a démontré que l’aromatase, l’enzyme responsable de la conversion de la testostérone en estradiol, commence à être saturée à des doses proches de 600 mg par semaine [8]. On peut l’observer sur l’image ci-dessous, où la ligne en pointillé représente la concentration estimée d’estradiol atteinte avec une certaine concentration totale de testostérone.
![Image empruntée à Lakshman et al. [8].](https://fr.thinksteroids.com/wp-content/uploads/2022/02/lakshman-testosterone-estradiol-570x441.jpg)
| Anglais | Français |
| Young men Baseline | Hommes jeunes Niveau de référence |
Pour le contexte, une dose de 600 mg par semaine rapporte une concentration nadirale de testostérone d’environ 82 nmol/L (2,370 ng/dL) [9]. Attendu que la demi-vie à l’état stationnaire des injections intramusculaires d’énanthate de testostérone est d’environ 1 semaine [10], cela signifie que la concentration de testostérone aurait oscillé entre environ 82 et 164 nmol/L (2,370 et 4,740 ng/dL) au cours d’une semaine. A ces concentrations on peut voir que les concentrations correspondantes d’estradiol se stabilisent et n’augmentent plus beaucoup. Au-dessus d’environ 150 nmol/L (4,320 ng/dL) il n’y a pratiquement plus d’augmentation significative d’estradiol. L’augmentation de testostérone conduit à une augmentation d’estradiol d’une magnitude proportionnelle moindre. Par conséquent, on peut en déduire que les doses supérieures à 600 mg d’énanthate de testostérone par semaine ne sont pas beaucoup plus susceptibles de causer la gynécomastie, car il n’y a plus d’augmentation d’estradiol. (À l’exception des hommes plus âgés chez qui la saturation commence à se manifester à des concentrations de testostérone supérieures à celles des hommes plus jeunes.)
Les androgènes et les œstrogènes
Les androgènes et les œstrogènes sont les principaux acteurs du développement de la gynécomastie. Il y a un consensus dans les publications selon lequel la cause en est essentiellement un déséquilibre entre l’action androgénique et l’action ostrogénique sur le tissu mammaire [11]. En un mot : les androgènes inhibent sa croissance, alors que les œstrogènes stimulent sa croissance. À ce titre, le coupable est un excès absolu ou relatif d’action ostrogénique, ou une insuffisance absolue ou relative d’action androgénique sur le tissu mammaire.
Comme chacun le sait, si on administre de la testostérone, on n’augmente pas uniquement les androgènes dans le corps. Comme indiqué ci-dessus, l’enzyme aromatase va convertir une partie de cette testostérone en œstrogène estradiol. Par conséquent, vous observerez pratiquement toujours des niveaux accrus d’estradiol chez les utilisateurs de SAA qui s’administrent des niveaux élevés de testostérone. Cependant, il faut noter que cela ne diminue pas le rapport androgènes-œstrogènes (qui joue un rôle dans le développement de la gynécomastie). Cela est particulièrement vrai à des doses plus élevées, comme expliqué précédemment à cause de la saturation de l’enzyme aromatase. Ceci est parfaitement illustré dans le diagramme ci-dessous que j’ai emprunté à ce même article (Tenir compte du fait que c’est le rapport estradiol testostérone qui est illustré plutôt que l’inverse) :
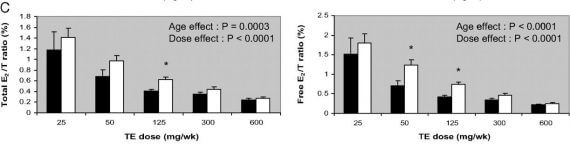
| Anglais | Français |
| Total E2/T ratio (%) Age effect Dose effect Free E2/T ratio (%) TE Dose (mg/wk) | Total rapport E2/T Effet de l’âge Effet de la dose Rapport libre E2 /T Dose TE (mg/semaine) |
En conséquence, il semble peu probable qu’un rapport androgène œstrogène diminué soit à blâmer pour le développement d’une gynécomastie pendant un tel cycle. Il semble davantage probable que l’excès absolu d’œstrogène soit le coupable. Par souci d’exhaustivité, cependant, il demeure la possibilité que le rapport sérique ne reflète pas ce qui se passe dans le tissu mammaire lui-même. Il n’existe malheureusement aucune donnée à ce sujet.
Bien sûr, la situation est fortement différente immédiatement après une cure. Pendant que les androgènes exogènes évacuent votre corps, votre propre production endogène ne sera pas opérationnelle immédiatement. Il va y avoir une période transitoire d’au moins plusieurs semaines voire mois, au cours de laquelle la production endogène de testostérone est gravement freinée. Par conséquent, il y a une insuffisance absolue d’androgènes dans le corps, il y a également moins d’œstrogène. Cependant, le rapport androgènes-œstrogènes dans cette situation tend souvent vers l’extrémité inférieure. Ce qui signifie qu’il y a relativement plus d’action oestrogénique. Cela peut donner lieu au développement d’une gynécomastie post-cycle.
Prolactine
La prolactine est une hormone qui possède des propriétés lactogéniques. Cela implique qu’elle a le potentiel de stimuler la production de lait des seins. En outre, elle supprime fortement la sécrétion des gonadotropes LH et FSH [12], qui a leur tour sont responsables de la production de testostérone. Par conséquent, le rapport androgènes-œstrogènes peut baisser, ce qui peut donner lieu à une gynécomastie.
Cela arrive chez les hommes qui souffrent d’hyperprolactinémie, c.-à-d. les hommes qui ont des niveaux élevés de prolactine. Cette pathologie peut être causée par des tumeurs qui la secrètent (macroadénomes ou prolactinomes). Cela peut également se produire dans le cas d’une insuffisance rénale chronique (bien que cela donnerait lieu à des niveaux modérément élevés). En outre, certains médicaments ont la réputation d’augmenter la prolactine. Certains en particulier sont des inhibiteurs sélectifs du recaptage de la sérotonine (SSRI), des opiacés et des neuroleptiques comme la rispéridone [13]. Ce qui est particulièrement intéressant dans le contexte du présent article, c’est que les œstrogènes et les antiandrogènes peuvent également augmenter la prolactine. Dans de rares cas, il a été noté que la conversion de la testostérone en estradiol dans la thérapie de remplacement de la testostérone avait cet effet [14]. Les androgènes, en particulier, réduisent la prolactine [15]. À ce titre, avec des doses d’androgènes extrêmement élevées, l’effet net sera toujours dirigé vers la suppression. Si la prolactine augmente au cours d’une cure, il s’agit plus probablement d’une action oestrogénique manifeste.
Le rôle direct de la prolactine dans la gynécomastie, le cas échéant, est à tout dire incertain. Si elle joue un rôle, il s’agit au mieux d’un rôle mineur. Par exemple, dans une série de 30 cas de gynécomastie, la majorité de ces derniers (~80 %) ne semblait pas exprimer de récepteur de la prolactine dans le tissu mammaire [16]. Si cela est vrai en général, alors la prolactine ne peut affecter le tissu mammaire que chez un petit pourcentage de personnes. De plus, il n’existe pas vraiment de mécanisme selon lequel la prolactine provoque la gynécomastie. On observe juste une certaine spéculation dans les publications, basée sur les effets de la régulation croisée entre les hormones de croissance et la progestérone dans les lignées de cellule cancéreuses du sein [17]. Dans une autre étude, les chercheurs ont incubé deux lignées de cellule cancéreuses du sein avec de la prolactine et cela a diminué l’ARNm du récepteur androgène et l’activité de liaison [18]. Mais si les lignées de cellule cancéreuses du sein m’ont appris une chose, c’est que ces dernières réagissent aux stimuli externes, en particulier les hormones, de manière totalement différente des cellules normales du sein. (Extrapoler quelque chose comme ça au développement de la gynécomastie a peu à voir avec la science, il s’agit juste d’une mauvaise interprétation de l’étude des cellules.)
Comme note finale, j’ai souvent eu des gens qui affirmaient avoir une prolactine élevée et qui après un bilan sanguin, s’avéraient avoir des niveaux normaux. On ne “sent” pas son niveau de prolactine, il faut le mesurer pour en être certain.
Progestérone
La progestérone est une de ces hormones qui joue également un rôle d’arrière-plan dans la physiologie masculine. Tout comme les androgènes et les œstrogènes, la progestérone est une hormone stéroïde. C’est surtout un important précurseur d’autres hormones stéroïdes (aldostérone et cortisol). Elle affecte également le cerveau [19], incluant votre sommeil [20]. Mais je m’égare. La raison pour laquelle je mentionne la progestérone dans cet article, c’est qu’elle est censée jouer un rôle dans la gynécomastie, et par conséquent, les stéroïdes anabolisants.
Tout d’abord, les SAA n’augmentent pas la progestérone, c’est déjà ça. Cependant, certains stéroïdes anabolisants présentent une certaine affinité raisonnable pour le récepteur de la progestérone, et pourraient ainsi avoir des effets progestogéniques. Et ils ont non seulement une affinité, un bioessai sur le gène rapporteur mammalien indique également une certaine activité pour certains SAA [21]. Le mibolérone (alias Cheque Drops) et la méthyltriénolone, en sont d’excellents exemples, tous deux semblent assez puissants à cet effet. Le trenbolone et le nandrolone en sont d’autres exemples, à un degré moindre. La plupart des autres SAA, comme la testostérone, le stanozolol, l’oxandrolone, le méthénolone, etc. n’activent pas le récepteur de la progestérone. Et s’ils le font, c’est uniquement à des concentrations absurdes. (Donc en pratique : ce n’est pas le cas.)
Alors, ces composés peuvent-ils potentiellement donner lieu à une gynécomastie ? Dans une certaine mesure, la progestérone contrôle la prolifération et la morphogenèse de l’épithélium luminal du sein (au moins chez les femmes) [22]. Ce qu’il faut savoir, c’est que les cellules de l’épithélium luminal sont celles qui donnent forme aux canaux lactifères. Ils ne contribuent pas en soi à la masse du sein, le tissu lobulaire/glandulaire. Ce tissu, d’après ce que je peux trouver dans les publications, n’est pas affecté par l’action progestéronique directe. Il ne reste qu’un rôle indirect. En effet, il a été suggéré que cela amplifie l’effet de l’estradiol sur le tissu mammaire. Il n’existe malheureusement aucune donnée humaine à ce sujet, seule une étude sur les primates le suggère [23]. Ainsi les éléments probants associant la progestérone au développement de la gynécomastie sont rares dans le meilleur des cas. Mais ce qui constitue peut-être le meilleur élément probant s’y opposant est une étude sur la contraception masculine dans le cadre de laquelle les hommes ont reçu100 mg d’énanthate de testostérone par semaine en conjonction avec une dose élevée de progestogène lévonorgestrel (0,5 mg par jour) pendant 6 mois [24]. Aucune gynécomastie n’a été observée chez aucun des hommes.
Bien sûr, maintenant que j’ai éveillé votre curiosité quant à la meilleure façon de soigner la gynécomastie. Cela sera la source d’un prochain article.
Références
- Melmed, S., Auchus, R.J., Goldfine, A.B., Koenig, R.J., & Rosen, C.J. (2019). Williams Textbook of Endocrinology (14th ed.). Elsevier.
- Georgiadis, E., et al. “Incidence of gynaecomastia in 954 young males and its relationship to somatometric parameters.” Annals of human biology 21.6 (1994): 579-587.
- Nuttall, Frank Q. “Gynecomastia as a physical finding in normal men.” The Journal of Clinical Endocrinology & Metabolism 48.2 (1979): 338-340.
- Smit, Diederik L., and Willem de Ronde. “Outpatient clinic for users of anabolic androgenic steroids: an overview.” Neth J Med 76.4 (2018): 167.
- Rohn, Reuben D. “Benign galactorrhea/breast discharge in adolescent males probably due to breast self-manipulation.” Journal of Adolescent Health Care 5.3 (1984): 210-212.
- Bhasin, Shalender, et al. “The effects of supraphysiologic doses of testosterone on muscle size and strength in normal men.” New England Journal of Medicine 335.1 (1996): 1-7.
- Bhasin, Shalender, et al. “Effect of testosterone supplementation with and without a dual 5α-reductase inhibitor on fat-free mass in men with suppressed testosterone production: a randomized controlled trial.” Jama 307.9 (2012): 931-939.
- Lakshman, Kishore M., et al. “The effects of injected testosterone dose and age on the conversion of testosterone to estradiol and dihydrotestosterone in young and older men.” The Journal of Clinical Endocrinology & Metabolism 95.8 (2010): 3955-3964.
- Bhasin, Shalender, et al. “Testosterone dose-response relationships in healthy young men.” American Journal of Physiology-Endocrinology And Metabolism (2001).
- Kaminetsky, Jed, Jonathan S. Jaffe, and Ronald S. Swerdloff. “Pharmacokinetic profile of subcutaneous testosterone enanthate delivered via a novel, prefilled single‐use autoinjector: a phase ii study.” Sexual medicine 3.4 (2015): 269-279.
- Narula, Harmeet S., and Harold E. Carlson. “Gynaecomastia—pathophysiology, diagnosis and treatment.” Nature Reviews Endocrinology 10.11 (2014): 684.
- De Rosa, Michele, et al. “Hyperprolactinemia in men.” Endocrine 20.1 (2003): 75-82.
- La Torre, Daria, and Alberto Falorni. “Pharmacological causes of hyperprolactinemia.” Therapeutics and Clinical Risk Management 3.5 (2007): 929.
- Sodi, R., et al. “Testosterone replacement-induced hyperprolactinaemia: case report and review of the literature.” Annals of clinical biochemistry 42.2 (2005): 153-159.
- Gooren, L. J. G., et al. “Prolactin secretion in the human male is increased by endogenous oestrogens and decreased by exogenous/endogenous androgens.” International journal of andrology 7.1 (1984): 53-60.
- Ferreira, M., et al. “Prolactin receptor expression in gynaecomastia and male breast carcinoma.” Histopathology 53.1 (2008): 56-61.
- Sansone, Andrea, et al. “Gynecomastia and hormones.” Endocrine 55.1 (2017): 37-44.
- Ormandy, Christopher J., et al. “Coexpression and cross-regulation of the prolactin receptor and sex steroid hormone receptors in breast cancer.” The Journal of Clinical Endocrinology & Metabolism 82.11 (1997): 3692-3699.
- Schumacher, Michael, et al. “Revisiting the roles of progesterone and allopregnanolone in the nervous system: resurgence of the progesterone receptors.” Progress in neurobiology 113 (2014): 6-39.
- Friess, Elisabeth, et al. “Progesterone-induced changes in sleep in male subjects.” American Journal of Physiology-Endocrinology and Metabolism 272.5 (1997): E885-E891.
- Houtman, Corine J., et al. “Detection of anabolic androgenic steroid abuse in doping control using mammalian reporter gene bioassays.” Analytica chimica acta 637.1-2 (2009): 247-258.
- Obr, Alison E., and Dean P. Edwards. “The biology of progesterone receptor in the normal mammary gland and in breast cancer.” Molecular and cellular endocrinology 357.1-2 (2012): 4-17.
- Zhou, Jian, et al. “Testosterone inhibits estrogen‐induced mammary epithelial proliferation and suppresses estrogen receptor expression.” The FASEB Journal 14.12 (2000): 1725-1730.
- Bebb, Richard A., et al. “Combined administration of levonorgestrel and testosterone induces more rapid and effective suppression of spermatogenesis than testosterone alone: a promising male contraceptive approach.” The Journal of Clinical Endocrinology & Metabolism 81.2 (1996): 757-762.








Leave a Reply