John Jeeves
Well-Known Member
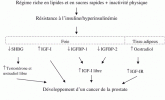
L’insuline est un facteur de croissance qui régule la prolifération cellulaire, l’expression des gènes, la synthèse des protéines et la survie cellulaire dans la plupart des tissus mammifères. Elle permet l'anabolisme cellulaire et s'oppose au catabolisme. C'est une hormone indispensable à la vie, car sans elle, la glycémie s'élèverait inexorablement jusqu'à la mort de l'individu. Mal utilisée, elle peut s’avérer néfaste et dangereuse. Des maladies peuvent s'installer progressivement et discrètement. (Diabète, obésité...)
Nous allons voir dans trois articles à quoi sert cette hormone, comment peut-on la stimuler et comment le sportif peut -il la sécréter de manière utile, pour avoir un avantage optimal sur sa prise de muscle et ses performances.
1ère partie/Régulation du métabolisme et insuline :
La régulation du métabolisme des protéines est soumise à des conditions spécifiques :
Cette régulation est d'une part hormonale, d'autre part nutritionnelle (c'est-à-dire par les substrats eux-mêmes). Cette distinction est artificielle puisque dans la majorité des circonstances physiologiques, ces deux modes de régulation sont simultanés et agissent en synergie lors de la prise alimentaire.
Régulation hormonale :
Les hormones peuvent être anabolisantes, c'est-à-dire favorisant le gain protéique, ou catabolique, favorisant la perte protéique.
Régulation nutritionnelle, elle est envisagée sous deux aspects :
Hormones pancréatiques :
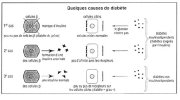
Le pancréas endocrine est organisé sous forme d'îlots de Langerhans au sein du tissu exocrine. Les îlots comportent 4 types cellulaires principaux.
Le pancréas centre de la régulation de la glycémie :
Le pancréas est un organe à double fonction Le pancréas exocrine fabrique des enzymes digestives qui sont ensuite déversées dans l'intestin pour participer à la digestion. Le pancréas endocrine qui nous concerne aujourd'hui synthétise deux hormones qui passeront dans le sang pour réguler le taux de sucre.
- Le glucagon qui fait augmenter la glycémie quand elle devient trop basse en transformant les graisses en sucres.
- L'insuline qui fait baisser la glycémie quand cela est nécessaire en faisant rentrer le sucre dans les cellules graisseuses où il est transformé en graisse de stockage.
La diminution d'insuline augmente les effets du glucagon :
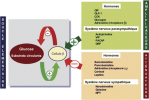
L’insuline et le glucagon sont les deux hormones majeures de l'homéostasie du glucose et participent donc à son équilibre. Qu’elles aient effet d'élever la glycémie ou d’empêcher sa montée, les hormones de l'homéostasie du glucose participent de manière coordonnée au maintien d'une glycémie constante.
L'insuline :
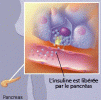
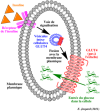
L'insuline parfois appelée ''hormone de stockage'' est le principal facteur de contrôle du métabolisme organique. L'insuline est une hormone hypoglycémiante polypeptide de 51 acides aminés produite par le pancréas endocrine en réponse à une hyperglycémie.
Elle est synthétisée à partir d'une pré-hormone, la préproinsuline. La suppression de peptide de signal génère la proinsuline.
La proinsuline comporte l'insuline et un peptide de connexion au milieu appelé peptide-C. Elle est composée de 2 chaînes liées par deux-ponts disulfures stables au niveau des cystéines. Ils sont indispensables à l'activité biologique de l'insuline. Sa structure a été remarquablement conservée au cours de l'évolution. Sa production et sa sécrétion par les cellules β du pancréas endocrine sont très étroitement contrôlées.
La transcription du gène de l'insuline est sous le contrôle de nombreux facteurs qui agissent en trans sur la région promotrice. L'hormone définitive est d'abord synthétisée sous la forme d'une protéine de haut poids moléculaire, la proinsuline, qui est stockée dans des microvésicules où s'amorce sa conversion en insuline. La libération de l'insuline nécessite la mise en route du processus d'exocytose des vésicules sécrétoires.
Le contrôle de la sécrétion de l'hormone fait appel à une boucle élémentaire de régulation qui lie la concentration des nutriments, en premier lieu le glucose, à la sécrétion d'insuline. Des agents modulateurs, hormonaux ou nerveux se greffent sur cette boucle pour atténuer ou amplifier cette sécrétion.
Le glucose est l'agent stimulant le plus puissant de la sécrétion d'insuline :
Il conditionne l'action de tous les autres stimuli. Son métabolisme dans la cellule β génère des cofacteurs, dont notamment l'adénosine triphosphorique, à l'origine de phénomènes électriques membranaires et de mouvements ioniques aboutissant à l'entrée massive de calcium dans la cellule et à la stimulation de l'exocytose.
Ce qui nous fait penser que lors d'un régime, on baisse la quantité de glucides pour maigrir en effet pour perdre du poids, il faut être en déficit calorique et que l'insuline soit basse.
(On parle bien d'une perte de masse grasse et non de perte de masse musculaire, car on peut être en déficit calorique et ne perdre que du muscle.)
Pourquoi hormone hypoglycémiante ?
Car l'insuline en faisant pénétrer le glucose dans les cellules musculaires, hépatiques et adipeuses, fait diminuer par la suite le taux sanguin nommé glycémie plasmatique. C’est la seule hormone hypoglycémiante du corps.
Sécrétion physiologique et niveau d'insuline :
Lorsqu'on ingère par exemple un repas contenant, 50 à 150 g de glucides, le glucose sera évacué du sang dans l'heure qui suit, cependant l'insuline restera présente pendant encore deux heures. Même si le glucose a été évacué du sang, l'insuline garde toujours son élévation. Lorsque qu'on ingère plus de 200 grammes de glucides, c'est le même principe, l'insuline reste élevée pendant environ 4 à 5 heures. Cette phase est anabolique.
Lorsque les réserves de glycogène sont pleines, le corps va les mettre en stockage dans les cellules graisseuses et si elles sont pleines, il va en créer d'autres et augmenter les enzymes aromatisantes. C'est pour cette raison que lorsqu'on s’entraîne sérieusement, il faut 24 à 48 heures pour remplir les réserves de glycogène et ainsi créer une surcompensation. Chaque repas apporte tout au long de la journée des glucides permettant un stockage optimal. Car chaque repas n’engendre pas une réponse insulinique trop forte, donc stabilise la glycémie et en même temps refait le stock de réserves énergétiques.
L'insuline permet de stocker les nutriments dans la cellule musculaire. Le muscle est constitué d'eau d'acide aminés et d'autres nutriments essentiels. Lors d'une injection d’insuline, les cellules musculaires vont capter les nutriments essentiels pour permettre l'anabolisme, par conséquent, on récupère mieux, le muscle paraît plus gros ...
À noter aussi que lorsqu’on prend de l'insuline le but va d'être d'apporter une grande quantité de protéines et peu de glucides, pour en fait éviter la prise de gras due au remplissage excessif de glucides par les cellules adipocytes.
C'est le même principe que lorsqu'on consomme une bonne quantité de protéines 40 à 50 grammes après l’entraînement, le corps va utiliser une partie, mais en oxyder une autre. Donc il n'y aura pas stockage, car il y a très peu de glucides.
(On peut recharger les réserves en glycogène pendant les repas qui suivent 24 à 48 heures selon l'intensité de l’entraînement.)
Ce qui pour nous par exemple athlète nous arrange, car c'est à ce moment que le corps doit récupérer, c'est bien à ce moment qu'il faut lui donner une dose conséquente de protéines. En revanche, si on apporte une très grande quantité de glucides rapide après l’entraînement le corps ne peut utiliser qu’une partie comme on l’a vu.
Passé donc un certain seuil cela se traduit par une prise de gras et donc un remplissage des adipocytes.
On peut faire une prise de masse et ne prendre que du gras, ne pas progresser à l’entraînement. Il y a certaines règles à respecter, le but n’est pas manger à outrance, mais apporter des produits de qualité, avec des bons nutriments et au bon moment.
On peut très bien faire un repas après l’entraînement, 1 heure max contenant aussi pas mal de protéines et de glucides. Dans ce cas-là, le corps va avoir une libération continue d'acides aminés constante même après le repas.
On peut aussi prendre des acides aminés puis faire directement après un repas, ou faire par exemple un mélange de whey et de caséine 50/50 avec des glucides : riz basmati, banane. (Pas trop de lipides ou fibres pour perturber la digestion, ce cas-là est vraiment un bon compris pour les personnes qui ne peuvent pas faire de repas directement et qui doivent travailler juste après).
S’il y a eu prise de glucides pendant l’entraînement, on peut faire un repas contenant des lipides peu importe, car on a déjà apporté les nutriments pendant la séance. (Tout repas de toute façon contient des lipides aussi minimes qu'il soit.)
Bien sûr, si la personne néglige ces moments autour de l’entraînement et qu'elle ne prend ni protéines, ou uniquement des glucides, des lipides ou autres, il se peut qu’elle ne progresse pas, voir même qu’elle régresse. Le débutant aura très peu d’impact, mais plus on avance dans l’entraînement, plus ils sont poussés et plus il faudra être minutieux si l'on veut arriver à nos objectifs.
Sources :
Société américaine pour la Nutrition J. Nutr. 136:533S-537S, Février 2006) Am J Physiol Endocrinol Metab. 2005 Avr.;288(4):E645-53; Am J Physiol Endocrinol Metab. 2006 Août 291(2):E381-7
Les nerfs musculaires. 2004 Juin;41(6):800-8
Y. Sauvaire, P. Petit, C. Broca, M. Manteghetti, Y. Baissac, J. Fernandez-Alavarez, R. Gross, M. Roye, A. Leconte, R. Gomis, G. Ribes ; 4-hydroxyisoleucine, Diabètes, 1998, 47, 206-210.Laboratoire de Pharmacologie - Faculté de Médecine - Université Montpellier 1.
aro JF, Dohm LG, Pories WJ, Sinha MK. Cellular alterations in liver, skeletal muscle, and adipose tissue responsible for insulin resistance in obesity and type II diabetes.Diabetes Metab Rev1989 ; 5 : 665-89.
Brillon DJ, Freidenberg GR, Henry RR, Olefsky JM. Mechanism of defective insulin-receptor kinase activity in NIDDM. Evidence for two receptor populations.Diabetes1989 ; 38 : 397-403.
Freidenberg GR, Reichart D, Olefsky JM, Henry RR. Reversibility of defective adipocyte insulin receptor kinase activity in non-insulin-dependent diabetes mellitus. Effect of weight loss.J Clin Inves 1988 ; 82 : 1398-406.
Thies FS, Molina JM, Ciaraldi TP, Freidenberg TP, Olefsky JM. Insulin-receptor autophosphorylation and endogenous substrate phosphorylation in human adipocytes from control obese, and NIDDM subjects.Diabetes1990 ; 39 : 250-9.
Garvey WT, Huecksteadt TP, Matthaei S, Olefsky JM. Role of glucose transporters in the cellular insulin resistance of type II non-insulin-dependent diabetes mellitus. J Clin Invest 1988 ; 81 : 1528-36.
Kahn BB. Facilitative glucose transporters : regulatory mechanisms and dysregulation in diabetes. J Clin Invest 1992 ; 89 : 1367-74.
Davidson MB. Editorial : Role of glucose transport and GLUT4 transporter protein in type 2 diabetes mellitus. J Clin Endocrinol Metab 1993 ; 77 : 25-6.Dohm GL, Tapscott EB, Pories WJ, et al. An in vitro human muscle preparation suitable for metabolic studies : decreased insulin stimulation of glucose transport in muscle from morbidly obese and diabetic subjects. J Clin Invest 1988 ; 82 : 486-94.
Nous allons voir dans trois articles à quoi sert cette hormone, comment peut-on la stimuler et comment le sportif peut -il la sécréter de manière utile, pour avoir un avantage optimal sur sa prise de muscle et ses performances.
1ère partie/Régulation du métabolisme et insuline :
La régulation du métabolisme des protéines est soumise à des conditions spécifiques :
Cette régulation est d'une part hormonale, d'autre part nutritionnelle (c'est-à-dire par les substrats eux-mêmes). Cette distinction est artificielle puisque dans la majorité des circonstances physiologiques, ces deux modes de régulation sont simultanés et agissent en synergie lors de la prise alimentaire.
Régulation hormonale :
Les hormones peuvent être anabolisantes, c'est-à-dire favorisant le gain protéique, ou catabolique, favorisant la perte protéique.
- L'insuline
- Hormone de croissance
- Catécholamines
- Glucorticoïdes
- Hormones thyroïdiennes et glucagon
- Cytokines (TNF, interleukines)
Régulation nutritionnelle, elle est envisagée sous deux aspects :
- D'abord la régulation par les substrats eux-mêmes, qu'il s'agisse des acides aminés ou des autres substrats énergétiques,
- Et l'évolution du métabolisme protéique au cours des différentes circonstances nutritionnelles que sont le repas et le jeûne
Hormones pancréatiques :
Le pancréas endocrine est organisé sous forme d'îlots de Langerhans au sein du tissu exocrine. Les îlots comportent 4 types cellulaires principaux.
- Les cellules bêta qui sécrètent l'insuline et représentent 60 à 80 % de la population cellulaire de l'îlot.
- Les cellules alpha qui sécrètent le glucagon
- Les cellules delta qui sécrètent la somatostatine
- Les cellules PP qui sécrètent le polypeptide pancréatique.
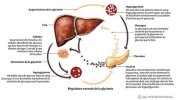
Le pancréas centre de la régulation de la glycémie :
Le pancréas est un organe à double fonction Le pancréas exocrine fabrique des enzymes digestives qui sont ensuite déversées dans l'intestin pour participer à la digestion. Le pancréas endocrine qui nous concerne aujourd'hui synthétise deux hormones qui passeront dans le sang pour réguler le taux de sucre.
- Le glucagon qui fait augmenter la glycémie quand elle devient trop basse en transformant les graisses en sucres.
- L'insuline qui fait baisser la glycémie quand cela est nécessaire en faisant rentrer le sucre dans les cellules graisseuses où il est transformé en graisse de stockage.
La diminution d'insuline augmente les effets du glucagon :
L’insuline et le glucagon sont les deux hormones majeures de l'homéostasie du glucose et participent donc à son équilibre. Qu’elles aient effet d'élever la glycémie ou d’empêcher sa montée, les hormones de l'homéostasie du glucose participent de manière coordonnée au maintien d'une glycémie constante.
L'insuline :

L'insuline parfois appelée ''hormone de stockage'' est le principal facteur de contrôle du métabolisme organique. L'insuline est une hormone hypoglycémiante polypeptide de 51 acides aminés produite par le pancréas endocrine en réponse à une hyperglycémie.
Elle est synthétisée à partir d'une pré-hormone, la préproinsuline. La suppression de peptide de signal génère la proinsuline.
La proinsuline comporte l'insuline et un peptide de connexion au milieu appelé peptide-C. Elle est composée de 2 chaînes liées par deux-ponts disulfures stables au niveau des cystéines. Ils sont indispensables à l'activité biologique de l'insuline. Sa structure a été remarquablement conservée au cours de l'évolution. Sa production et sa sécrétion par les cellules β du pancréas endocrine sont très étroitement contrôlées.
La transcription du gène de l'insuline est sous le contrôle de nombreux facteurs qui agissent en trans sur la région promotrice. L'hormone définitive est d'abord synthétisée sous la forme d'une protéine de haut poids moléculaire, la proinsuline, qui est stockée dans des microvésicules où s'amorce sa conversion en insuline. La libération de l'insuline nécessite la mise en route du processus d'exocytose des vésicules sécrétoires.
Le contrôle de la sécrétion de l'hormone fait appel à une boucle élémentaire de régulation qui lie la concentration des nutriments, en premier lieu le glucose, à la sécrétion d'insuline. Des agents modulateurs, hormonaux ou nerveux se greffent sur cette boucle pour atténuer ou amplifier cette sécrétion.
Le glucose est l'agent stimulant le plus puissant de la sécrétion d'insuline :
Il conditionne l'action de tous les autres stimuli. Son métabolisme dans la cellule β génère des cofacteurs, dont notamment l'adénosine triphosphorique, à l'origine de phénomènes électriques membranaires et de mouvements ioniques aboutissant à l'entrée massive de calcium dans la cellule et à la stimulation de l'exocytose.
Ce qui nous fait penser que lors d'un régime, on baisse la quantité de glucides pour maigrir en effet pour perdre du poids, il faut être en déficit calorique et que l'insuline soit basse.
(On parle bien d'une perte de masse grasse et non de perte de masse musculaire, car on peut être en déficit calorique et ne perdre que du muscle.)
Pourquoi hormone hypoglycémiante ?
Car l'insuline en faisant pénétrer le glucose dans les cellules musculaires, hépatiques et adipeuses, fait diminuer par la suite le taux sanguin nommé glycémie plasmatique. C’est la seule hormone hypoglycémiante du corps.
Sécrétion physiologique et niveau d'insuline :
- Sécrétion physiologique de l’insuline par les cellules bêta des îlots de Langerhans :
- Sécrétion basale : 0.5 u.i./kg /j.
- Sécrétion à la demande (élévation de la glycémie par le repas) : 0.3 à 0.5 u.i./kg/j.
- Sécrétion totale journalière d’insuline : 0.8 à 1 u.i./kg/j.
Lorsqu'on ingère par exemple un repas contenant, 50 à 150 g de glucides, le glucose sera évacué du sang dans l'heure qui suit, cependant l'insuline restera présente pendant encore deux heures. Même si le glucose a été évacué du sang, l'insuline garde toujours son élévation. Lorsque qu'on ingère plus de 200 grammes de glucides, c'est le même principe, l'insuline reste élevée pendant environ 4 à 5 heures. Cette phase est anabolique.
Lorsque les réserves de glycogène sont pleines, le corps va les mettre en stockage dans les cellules graisseuses et si elles sont pleines, il va en créer d'autres et augmenter les enzymes aromatisantes. C'est pour cette raison que lorsqu'on s’entraîne sérieusement, il faut 24 à 48 heures pour remplir les réserves de glycogène et ainsi créer une surcompensation. Chaque repas apporte tout au long de la journée des glucides permettant un stockage optimal. Car chaque repas n’engendre pas une réponse insulinique trop forte, donc stabilise la glycémie et en même temps refait le stock de réserves énergétiques.

L'insuline permet de stocker les nutriments dans la cellule musculaire. Le muscle est constitué d'eau d'acide aminés et d'autres nutriments essentiels. Lors d'une injection d’insuline, les cellules musculaires vont capter les nutriments essentiels pour permettre l'anabolisme, par conséquent, on récupère mieux, le muscle paraît plus gros ...
À noter aussi que lorsqu’on prend de l'insuline le but va d'être d'apporter une grande quantité de protéines et peu de glucides, pour en fait éviter la prise de gras due au remplissage excessif de glucides par les cellules adipocytes.
C'est le même principe que lorsqu'on consomme une bonne quantité de protéines 40 à 50 grammes après l’entraînement, le corps va utiliser une partie, mais en oxyder une autre. Donc il n'y aura pas stockage, car il y a très peu de glucides.
(On peut recharger les réserves en glycogène pendant les repas qui suivent 24 à 48 heures selon l'intensité de l’entraînement.)
Ce qui pour nous par exemple athlète nous arrange, car c'est à ce moment que le corps doit récupérer, c'est bien à ce moment qu'il faut lui donner une dose conséquente de protéines. En revanche, si on apporte une très grande quantité de glucides rapide après l’entraînement le corps ne peut utiliser qu’une partie comme on l’a vu.
Passé donc un certain seuil cela se traduit par une prise de gras et donc un remplissage des adipocytes.
On peut faire une prise de masse et ne prendre que du gras, ne pas progresser à l’entraînement. Il y a certaines règles à respecter, le but n’est pas manger à outrance, mais apporter des produits de qualité, avec des bons nutriments et au bon moment.
On peut très bien faire un repas après l’entraînement, 1 heure max contenant aussi pas mal de protéines et de glucides. Dans ce cas-là, le corps va avoir une libération continue d'acides aminés constante même après le repas.
On peut aussi prendre des acides aminés puis faire directement après un repas, ou faire par exemple un mélange de whey et de caséine 50/50 avec des glucides : riz basmati, banane. (Pas trop de lipides ou fibres pour perturber la digestion, ce cas-là est vraiment un bon compris pour les personnes qui ne peuvent pas faire de repas directement et qui doivent travailler juste après).
S’il y a eu prise de glucides pendant l’entraînement, on peut faire un repas contenant des lipides peu importe, car on a déjà apporté les nutriments pendant la séance. (Tout repas de toute façon contient des lipides aussi minimes qu'il soit.)
Bien sûr, si la personne néglige ces moments autour de l’entraînement et qu'elle ne prend ni protéines, ou uniquement des glucides, des lipides ou autres, il se peut qu’elle ne progresse pas, voir même qu’elle régresse. Le débutant aura très peu d’impact, mais plus on avance dans l’entraînement, plus ils sont poussés et plus il faudra être minutieux si l'on veut arriver à nos objectifs.

Sources :
Société américaine pour la Nutrition J. Nutr. 136:533S-537S, Février 2006) Am J Physiol Endocrinol Metab. 2005 Avr.;288(4):E645-53; Am J Physiol Endocrinol Metab. 2006 Août 291(2):E381-7
Les nerfs musculaires. 2004 Juin;41(6):800-8
Y. Sauvaire, P. Petit, C. Broca, M. Manteghetti, Y. Baissac, J. Fernandez-Alavarez, R. Gross, M. Roye, A. Leconte, R. Gomis, G. Ribes ; 4-hydroxyisoleucine, Diabètes, 1998, 47, 206-210.Laboratoire de Pharmacologie - Faculté de Médecine - Université Montpellier 1.
aro JF, Dohm LG, Pories WJ, Sinha MK. Cellular alterations in liver, skeletal muscle, and adipose tissue responsible for insulin resistance in obesity and type II diabetes.Diabetes Metab Rev1989 ; 5 : 665-89.
Brillon DJ, Freidenberg GR, Henry RR, Olefsky JM. Mechanism of defective insulin-receptor kinase activity in NIDDM. Evidence for two receptor populations.Diabetes1989 ; 38 : 397-403.
Freidenberg GR, Reichart D, Olefsky JM, Henry RR. Reversibility of defective adipocyte insulin receptor kinase activity in non-insulin-dependent diabetes mellitus. Effect of weight loss.J Clin Inves 1988 ; 82 : 1398-406.
Thies FS, Molina JM, Ciaraldi TP, Freidenberg TP, Olefsky JM. Insulin-receptor autophosphorylation and endogenous substrate phosphorylation in human adipocytes from control obese, and NIDDM subjects.Diabetes1990 ; 39 : 250-9.
Garvey WT, Huecksteadt TP, Matthaei S, Olefsky JM. Role of glucose transporters in the cellular insulin resistance of type II non-insulin-dependent diabetes mellitus. J Clin Invest 1988 ; 81 : 1528-36.
Kahn BB. Facilitative glucose transporters : regulatory mechanisms and dysregulation in diabetes. J Clin Invest 1992 ; 89 : 1367-74.
Davidson MB. Editorial : Role of glucose transport and GLUT4 transporter protein in type 2 diabetes mellitus. J Clin Endocrinol Metab 1993 ; 77 : 25-6.Dohm GL, Tapscott EB, Pories WJ, et al. An in vitro human muscle preparation suitable for metabolic studies : decreased insulin stimulation of glucose transport in muscle from morbidly obese and diabetic subjects. J Clin Invest 1988 ; 82 : 486-94.
Dernière édition: